Żelazo (pierwiastek chemiczny): właściwości, struktura chemiczna, zastosowania
Żelazo jest metalem przejściowym znajdującym się w grupie VIIIB lub 8 układu okresowego pierwiastków. Jest to jeden z metali, który był świadomy od najwcześniejszych czasów. Chińczycy, Egipcjanie i Rzymianie pracowali z tym metalem. Łatwa ekstrakcja oznaczała etap historii znany jako epoka żelaza.
Jego nazwa wywodzi się od słowa „ferrum” w języku łacińskim, a zatem jego symbol chemiczny „Wiara” jest bardzo reaktywnym elementem, więc jego srebrny połysk zwykle nie występuje w naturze. W czasach starożytnych metal ten był w rzeczywistości skatalogowany o wartości wyższej niż złoto ze względu na jego rzekomą rzadkość.

Jego czysta forma została znaleziona w regionach Grenlandii i w skałach magmowych gleb Rosji. W przestrzeni gwiezdnej uważa się, że jest to obfity składnik meteorytów, które po uderzeniu w Ziemię zachowały skrystalizowane żelazo w swoich skalistych piersiach.
Ale ważniejsze niż czyste żelazo są jego związki; zwłaszcza jego tlenki. Tlenki te pokrywają powierzchnię Ziemi dużą rodziną minerałów, takich jak magnetyt, piryt, hematyt, getyt i wiele innych. W rzeczywistości zabarwienia obserwowane w marsjańskich górach i pustyniach wynikają w dużej mierze z hematytu.
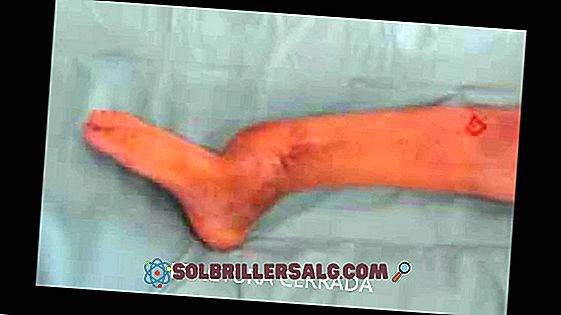
Żelazne przedmioty można znaleźć w miastach lub na polach. Te, które nie mają folii ochronnej, zmieniają kolor na czerwony, ponieważ ulegają korozji pod wpływem wilgoci i tlenu. Inne, jak latarnia głównego obrazu, pozostają szare lub czarne.
Szacuje się, że w rdzeniu Ziemi znajduje się ogromne stężenie tego metalu. Tak bardzo, że w stanie ciekłym, będącym produktem wysokich temperatur, może być odpowiedzialny za pole magnetyczne Ziemi.
Z drugiej strony żelazo nie tylko uzupełnia skorupę naszej planety, ale jest również częścią składników odżywczych wymaganych przez żywe istoty. Na przykład konieczne jest transportowanie tlenu do tkanek.
Charakterystyka żelaza
Czyste żelazo ma swoje własne cechy, które odróżniają go od minerałów. Jest to błyszczący, szarawy metal, który reaguje z tlenem i wilgocią w powietrzu, przekształcając się w odpowiadający mu tlenek. Gdyby w atmosferze nie było tlenu, wszystkie ozdoby i konstrukcje żelazne pozostałyby nienaruszone i wolne od czerwonej rdzy.
Ma wysoką wytrzymałość mechaniczną i twardość, ale jednocześnie jest plastyczny i ciągliwy. Dzięki temu kowale mogą wykuwać kawałki o wielu kształtach i konstrukcjach, poddając masy żelaza intensywnym temperaturom. Jest również dobrym przewodnikiem ciepła i elektryczności.
Ponadto jedną z jego najcenniejszych cech jest interakcja z magnesami i zdolność do namagnesowania. Ogół społeczeństwa otrzymał wiele pokazów wpływu magnesów na ruch wiórów żelaznych, a także zademonstrowania pola magnetycznego i biegunów magnesu.
Temperatura topnienia i wrzenia
Żelazo topi się w temperaturze 1535ºC i wrze w 2750ºC. W jego ciekłym i żarzącym się kształcie uzyskuje się ten metal. Dodatkowo jego temperatury topnienia i odparowywania wynoszą 13, 8 i 349, 6 kJ / mol.
Gęstość
Jego gęstość wynosi 7, 86 g / cm3. Oznacza to, że 1 ml tego metalu waży 7, 86 grama.
Izotopy
W układzie okresowym, szczególnie w grupie 8 okresu 4, znaleziono żelazo o masie atomowej około 56u (26 protonów, 26 elektronów i 30 neutronów). Jednak w naturze istnieją trzy inne stabilne izotopy żelaza, to znaczy mają taką samą liczbę protonów, ale różne masy atomowe.
56Fe jest najliczniejszym ze wszystkich (91, 6%), następnie 54Fe (5, 9%), 57Fe (2, 2%) i ostatecznie 58Fe (0, 33%). To właśnie te cztery izotopy tworzą całe żelazo zawarte na planecie Ziemia. W innych warunkach (pozaziemskich) te wartości procentowe mogą się różnić, ale 56Fe może nadal być najbardziej obfite.
Inne izotopy, o masach atomowych oscylujących między 46 a 69u, są bardzo niestabilne i mają czas połowicznego rozpadu krótszy niż cztery wymienione powyżej.
Toksyczność
Przede wszystkim jest to nietoksyczny metal. W przeciwnym razie wymagane byłyby specjalne zabiegi (chemiczne i fizyczne), a niezmierzone obiekty i budynki stanowiłyby ukryte ryzyko dla środowiska i życia.
Właściwości chemiczne
Elektroniczna konfiguracja żelaza to [Ar] 3d64s2, co oznacza, że wnosi on dwa elektrony z orbitalu 4s i sześć z orbitali 3d, tworząc swoje metalowe wiązania w krysztale. To właśnie ta krystaliczna struktura wyjaśnia niektóre właściwości, takie jak ferromagnetyzm.
Ponadto konfiguracja elektroniczna powierzchownie przewiduje stabilność jej kationów. Kiedy żelazo traci dwa swoje elektrony, Fe2 +, pozostaje w konfiguracji [Ar] 3d6 (zakładając, że orbital 4s jest tam, skąd pochodzą te elektrony). Podczas gdy traci trzy elektrony, Fe3 +, jego konfiguracja to [Ar] 3d5.
Doświadczalnie wykazano, że wiele jonów o konfiguracji walencyjnej nd5 ma wielką stabilność. Dlatego żelazo ma tendencję do utleniania się przeciwko gatunkom akceptującym elektrony, aby stać się kationem żelazowym Fe3 +; iw mniej utleniającym środowisku, w kationie żelazawym Fe2 +.
Następnie w medium o małej zawartości tlenu przeważają związki żelaza. PH wpływa również na stopień utlenienia żelaza, ponieważ w wysoce kwaśnym środowisku jego przemiana w Fe3 + jest preferowana.
Kolory jego związków
Fe2 + w roztworze jest zielonkawy, a Fe3 + w miękkim fioletu. Podobnie związki żelaza mogą mieć zielone lub czerwone kolory w zależności od tego, jaki jest kation i jakie jony lub cząsteczki je otaczają.
Odcienie zieleni zmieniają się w zależności od elektronicznego środowiska Fe2 +. Zatem FeO, tlenek żelazawy, jest bardzo ciemnozielonym ciałem stałym; podczas gdy FeSO4, siarczan żelazawy, ma jasnozielone kryształy. Inne związki Fe2 + mogą nawet mieć niebieskawe odcienie, jak w przypadku błękitu pruskiego.
Występuje również w fioletowych odcieniach Fe3 + w jego związkach, które mogą stać się czerwonawe. Na przykład hematyt, Fe 2 O 3, jest tlenkiem odpowiedzialnym za wiele kawałków żelaza wyglądających na czerwonawe.
Znaczna liczba związków żelaza jest jednak bezbarwna. Chlorek żelazowy, FeCl3, jest bezbarwny, ponieważ Fe3 + tak naprawdę nie występuje w formie jonowej, ale tworzy wiązania kowalencyjne (Fe-Cl).
Inne związki są w rzeczywistości złożonymi mieszaninami kationów Fe2 + i Fe3 +. Ich kolory zawsze będą uzależnione od tego, czy jony lub cząsteczki oddziałują z żelazem, chociaż jak wspomniano, znaczna większość ma tendencję do niebieskawej, fioletowej, czerwonawej (nawet żółtej) lub ciemnozielonej.
Stany utleniania
Jak wyjaśniono, żelazo może mieć stopień utlenienia lub wartościowość +2 lub +3. Jednakże możliwe jest również, że uczestniczy w niektórych związkach o wartościowości 0; to znaczy, nie cierpi na utratę elektronów.
W tego typu związkach żelazo uczestniczy w swojej surowej postaci. Na przykład Fe (CO) 5, pentakarbonyl żelaza, składa się z oleju otrzymanego przez ogrzewanie porowatego żelaza z tlenkiem węgla. Cząsteczki CO są umieszczone w pustych przestrzeniach cieczy, Fe jest skoordynowane z pięcioma z nich (Fe-C≡O).
Środki utleniające i redukujące
Który z kationów Fe2 + lub Fe3 + zachowuje się jak środek utleniający lub redukujący? Fe2 + w środowisku kwaśnym lub w obecności tlenu, traci elektron, by stać się Fe3 +; dlatego jest to czynnik redukujący:
Fe2 + => Fe3 + + e-
A Fe3 + zachowuje się jak środek utleniający w środowisku podstawowym:
Fe3 + + e- => Fe2 +
Lub nawet:
Fe3 + + 3e- => Wiara
Struktura chemiczna
Żelazo tworzy polimorficzne ciała stałe, to znaczy jego atomy metalu mogą przyjmować różne struktury krystaliczne. W temperaturze pokojowej jego atomy krystalizują w jednostkowej jednostce bcc: sześciennej wyśrodkowanej w ciele ( Body Centered Cubic ). Ta faza stała jest znana jako ferryt, Fe α.
Ta struktura bcc może wynikać z faktu, że żelazo jest metalem o konfiguracji d6, z elektroniczną pustką czterech elektronów.
Gdy temperatura wzrasta, atomy Fe wibrują z powodu efektu termicznego i przyjmują, po 906 ° C, zwartą kubiczną ccp: Sześcienną najbliższą zapakowaną strukturę . Jest to Fe γ, które wraca do fazy Fe α w temperaturze 1401ºC. Po tej temperaturze żelazo topi się w temperaturze 1535 ° C.
A co ze wzrostem ciśnienia? Kiedy to wzrasta, zmusza atomy kryształu do „ściśnięcia” w gęstszą strukturę: Fe β. Ten polimorf ma hcp: sześciokątną zwartą strukturę ( Hexagonal Closed Pack ).
Zastosowania / aplikacje
Strukturalne
Samo żelazo ma niewiele zastosowań. Jednakże, gdy jest pokryty innym metalem (lub stopem, takim jak cyna), jest chroniony przed korozją. Tak więc żelazo jest materiałem budowlanym obecnym w budynkach, mostach, bramach, posągach, samochodach, maszynach, transformatorach itp.
Gdy dodawane są małe ilości węgla i innych metali, wzmacniane są ich właściwości mechaniczne. Te rodzaje stopów są znane jako stale. Stal buduje prawie wszystkie branże i ich materiały.
Z drugiej strony żelazo zmieszane z innymi metalami (niektóre z metali ziem rzadkich) zostało wykorzystane do produkcji magnesów stosowanych w sprzęcie elektronicznym.
Biologiczne
Żelazo odgrywa istotną rolę w życiu. W naszych ciałach jest częścią niektórych białek, w tym enzymu hemoglobiny.
Bez hemoglobiny, nośnika tlenu dzięki metalicznemu centrum Fe3 +, tlen nie mógłby być transportowany do różnych obszarów ciała, ponieważ w wodzie jest bardzo nierozpuszczalny.
Hemoglobina przemieszcza się przez krew do komórek mięśniowych, gdzie pH jest kwaśne i obfituje w wyższe stężenia CO 2 . Tutaj zachodzi proces odwrotny, to znaczy tlen jest uwalniany z powodu warunków i jego niskiego stężenia w tych komórkach. Enzym ten może transportować w sumie cztery cząsteczki O 2 .
Jak to zdobędziesz?
Ze względu na swoją reaktywność znajduje się w skorupie ziemskiej tworząc tlenki, siarczki lub inne minerały. Dlatego niektóre z nich mogą być wykorzystane jako surowiec; wszystko będzie zależało od kosztów i trudności w redukcji żelaza w jego środowisku chemicznym.
W skali przemysłowej redukcja tlenków żelaza jest bardziej wykonalna niż w przypadku siarczków. Hematyt i magnetyt, Fe 3 O 4, są głównymi źródłami tego metalu, które reagują z węglem (w postaci koksu).
Żelazo otrzymane tą metodą jest płynne i żarowe, i jest opróżniane do wlewków wlewków (jak kaskada lawy). Ponadto mogą powstawać duże ilości gazów, które mogą być szkodliwe dla środowiska. Dlatego otrzymanie żelaza wymaga uwzględnienia wielu czynników.
Reakcje wewnątrz pieców
Bez nazywania szczegółów ich ekstrakcji i transportu, tlenki te są przenoszone wraz z koksem i wapieniem (CaCO 3 ) do wielkich pieców. Wyekstrahowane tlenki zawierają wszystkie rodzaje zanieczyszczeń, które reagują z CaO uwolnionym z rozkładu termicznego CaCO3.
Po załadowaniu partii surowca do pieca, w jego dolnej części płynie prąd powietrza o temperaturze 2000ºC, którego spalanie koksu do tlenku węgla:
2C (s) + O 2 (g) => 2CO (g) (2000 ° C)
Ten CO wznosi się na szczyt pieca, gdzie spotyka się z hematytem i redukuje go:
3Fe2O3 (s) + CO (g) => 2Fe3O4 (s) + CO 2 (g) (200ºC)
W magnetycie występują jony Fe2 +, produkty redukcji Fe3 + za pomocą CO. Następnie ten produkt jest nadal redukowany dzięki większej ilości CO:
Fe 3 O 4 (s) + CO (g) => 3 FeO (s) + CO 2 (g) (700 ° C)
Wreszcie FeO zostaje zredukowane do metalicznego żelaza, które topi się z powodu wysokich temperatur pieca:
FeO (s) + CO (g) => Fe (s) + CO 2 (g)
Wiara => Wiara (l)
W tym samym czasie CaO reaguje z krzemianami i zanieczyszczeniami, tworząc tzw. Ciekły żużel. Żużel ten jest mniej gęsty niż płynne żelazo, dlatego unosi się nad nim i obie fazy mogą się rozdzielić.