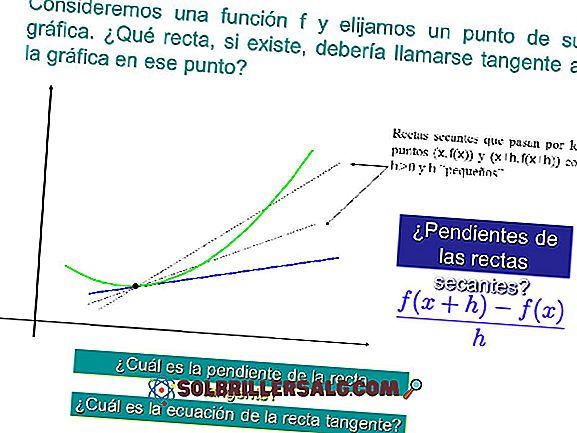
13 rodzajów reakcji chemicznych (z przykładami)
Rodzaje reakcji chemicznych są oparte na tym, co dzieje się na poziomie molekularnym; jakie linki są zerwane i jak łączą się z atomami. Ponadto bierze się pod uwagę, czy gatunki zyskują lub tracą elektrony; nawet jeśli w większości reakcji chemicznych tak się dzieje.
Materia może cierpieć na niezliczone rodzaje reakcji chemicznych lub transformacji, które ze względu na ich dużą liczbę wymagają pewnych kryteriów, aby odróżnić je od siebie. Zatem mogą występować zgodnie z charakterystykami termodynamicznymi, kinetycznymi, molekularnymi lub elektronicznymi.

Tworzenie pewnych związków wymaga szeregu reakcji. Na przykład patyna (niższy obraz), która obejmuje przedmioty z brązu lub miedzi, jest produktem utleniania miedzi w obecności wilgoci i kwasu węglowego; dlatego składa się z węglanu miedzi, CuCO 3 i innych soli tego metalu.

Dwutlenek węgla rozpuszcza się w wodzie, która zwilża powierzchnię miedzi, hydrolizując do kwasu węglowego. W konsekwencji pH staje się kwaśne i sprzyja utlenianiu miedzi i tworzeniu złożonej wody; który na koniec oddziałuje i wytrąca się z jonami węglanowymi ośrodka.
Poniżej wyjaśniamy różne typy zachodzących reakcji chemicznych.
Redukcja utleniania (redoks)
Utlenianie miedzi
W przykładzie patyny zachodzi reakcja utleniania: metaliczna miedź traci elektrony w obecności tlenu, aby przekształcić się w odpowiedni tlenek.
4Cu (s) + O 2 (g) => Cu 2 O (s)
Tlenek miedzi (I) nadal utlenia się, otrzymując tlenek miedzi (II):
2Cu 2 O (s) + O 2 => 4CuO (s)
Ten typ reakcji chemicznej, w której gatunki zwiększają lub zmniejszają liczbę (lub stan) utleniania, jest znany jako utlenianie i redukcja (redoks).
Metaliczna miedź o stopniu utlenienia 0 najpierw traci jeden elektron, a następnie drugi (jest utleniona), podczas gdy tlen zostaje (zredukowany):
Cu => Cu + + e-
Cu + => Cu2 + + e-
O 2 + 2e- => 2O2-
Wzmocnienie lub utratę elektronów można określić przez obliczenie liczb utlenienia atomów we wzorach chemicznych ich otrzymanych związków.
Wiadomo, że dla Cu 2 O, ponieważ jest to tlenek, mamy anion O2-, więc aby utrzymać ładunki neutralizowane, każdy z dwóch atomów miedzi musi mieć ładunek +1. Bardzo podobny do CuO.
Miedź po utlenieniu uzyskuje dodatnie liczby oksydacyjne; i tlenu, który ma być zredukowany, ujemne liczby utleniania.
Żelazo i kobalt
Dalsze przykłady reakcji redoks przedstawiono poniżej. Ponadto zostanie sporządzony krótki komentarz i zostaną określone zmiany w liczbach utleniania.
FeCl 2 + CoCl 3 => FeCl 3 + CoCl 2
Jeśli obliczane są liczby utleniania, należy zauważyć, że te z Cl pozostają ze stałą wartością -1; nie tak, z tymi z Faith and Co.
Na pierwszy rzut oka żelazo zostało utlenione, podczas gdy kobalt został zredukowany. Jak wiedzieć? Ponieważ żelazo oddziałuje teraz nie z dwoma anionami Cl-, ale z trzema, atom chloru (neutralny) jest bardziej elektroujemny niż żelazo i kobalt. Z drugiej strony, w przypadku kobaltu dzieje się odwrotnie: zdarza się, że oddziałuje on z trzema Cl- na dwa z nich.
Jeśli powyższe rozumowanie nie jest jasne, przystępujemy do pisania równań chemicznych transferu netto elektronów:
Fe2 + => Fe3 + + e-
Co3 + + e- => Co2 +
Dlatego Fe2 + jest utleniony, podczas gdy Co3 + jest zredukowany.
Jod i mangan
6KMnO4 + 5KI + 18HCl => 6MnCl2 + 5KIO 3 + 6KCl + 9H2O
Powyższe równanie chemiczne może wydawać się skomplikowane, ale tak nie jest. Chlor (Cl-) i tlen (O2-) doświadczają wzmocnienia lub utraty swoich elektronów. Jod i mangan, tak.
Biorąc pod uwagę tylko związki z jodem i manganem, masz:
KI => KIO 3 (liczba oksydacyjna: -1 do +5, traci sześć elektronów)
KMnO4 => MnCl2 (liczba oksydacyjna: +7 do +2, uzyskaj pięć elektronów)
Jod jest utleniony, podczas gdy mangan jest zredukowany. Jak wiedzieć bez obliczania? Ponieważ jod przechodzi od bycia z potasem do interakcji z trzema tlenami (bardziej elektroujemnymi); a mangan z drugiej strony traci interakcje z tlenem, aby być z chlorem (mniej elektroujemnym).
KI nie może stracić sześciu elektronów, jeśli KMnO 4 uzyska pięć; dlatego liczba elektronów musi być zrównoważona w równaniu:
5 (KI => KIO 3 + 6e-)
6 (KMnO4 + 5e- => MnCl2)
Co powoduje transfer netto 30 elektronów.
Spalanie
Spalanie jest energicznym i energetycznym utlenianiem, w którym uwalniane jest światło i ciepło. Ogólnie, w tego typu reakcji chemicznej tlen uczestniczy jako środek utleniający lub utleniający; podczas gdy czynnik redukujący jest paliwem, które pali się na końcu rachunku.
Tam, gdzie jest popiół, było spalanie. Składają się one zasadniczo z węgla i tlenków metali; chociaż jego skład logicznie zależy od rodzaju paliwa. Oto kilka przykładów:
C (s) + O 2 (g) => CO 2 (g)
2CO (g) + O 2 (g) => 2CO 2 (g)
C3H8 (g) + 502 (g) => 3CO 2 (g) + 4H 2O (g)
Każde z tych równań odpowiada całkowitym spaleniom; to znaczy, całe paliwo reaguje z nadmiarem tlenu, aby zagwarantować jego całkowitą przemianę.
Podobnie należy zauważyć, że CO2 i H2O są gazowymi produktami większościowymi, gdy spalają się ciała węglowe (takie jak drewno, węglowodory i tkanki zwierzęce). Nieuniknione jest powstawanie alotropu węgla z powodu braku tlenu, a także mniej natlenionych gazów, takich jak CO i NO.
Synteza

Na górnym obrazie pokazano prostą reprezentację. Każdy trójkąt jest związkiem lub atomem, które łączą się, tworząc pojedynczy związek; dwa trójkąty tworzą równoległobok. Wzrastają masy, a właściwości fizyczne i chemiczne produktu są często bardzo różne od jego reagentów.
Na przykład, spalanie wodoru (który jest także reakcją redoks) wytwarza wodorotlenek lub wodorek tlenu; lepiej znany jako woda:
H 2 (g) + O 2 (g) => 2 H 2 O (g)
Mieszając oba gazy w wysokiej temperaturze spalają one gazową wodę. Gdy temperatury są chłodzone, pary skraplają się, dając ciekłą wodę. Kilku autorów uważa tę reakcję syntezy za jedną z możliwych alternatyw dla zastąpienia paliw kopalnych w pozyskiwaniu energii.
Linki HH i O = O są łamane, tworząc dwa nowe proste linki: HOH. Woda, jak wiadomo, jest substancją nieporównywalną (poza romantycznym zmysłem), a jej właściwości są zupełnie różne od gazowego wodoru i tlenu.
Związki jonowe
Tworzenie związków jonowych z ich pierwiastków jest również przykładem reakcji syntezy. Jednym z najprostszych jest tworzenie halogenków metali z grup 1 i 2. Na przykład synteza bromku wapnia:
Ca (s) + Br 2 (l) => CaBr 2 (s)
Ogólne równanie dla tego typu syntezy to:
M (s) + X 2 => MX 2 (s)
Koordynacja
Gdy powstały związek zawiera atom metalu w geometrii elektronicznej, wówczas mówi się, że jest to kompleks. W kompleksach metale pozostają związane z ligandami przez słabe wiązania kowalencyjne i powstają w wyniku reakcji koordynacyjnych.
Na przykład mamy kompleks [Cr (NH 3 ) 6 ] 3+. Powstaje, gdy kation Cr3 + jest w obecności cząsteczek amoniaku, NH 3, które działają jako ligandy chromu:
Cr3 + + 6NH 3 => [Cr (NH 3 ) 6 ] 3+
Poniżej znajduje się wynikowy koordynacyjny ośmiościan wokół centrum chromowo-metalowego:

Należy zauważyć, że ładunek chromu 3+ nie jest neutralizowany w kompleksie. Jego kolor jest purpurowy i dlatego ośmiościan jest reprezentowany przez ten kolor.
Niektóre kompleksy są bardziej interesujące, jak w przypadku niektórych enzymów koordynujących atomy żelaza, cynku i wapnia.
Rozkład
Rozkład jest przeciwieństwem syntezy: związek jest podzielony na jeden, dwa lub trzy pierwiastki lub związki.
Na przykład mamy trzy następujące dekompozycje:
2HgO (s) => 2Hg (l) + O 2 (g)
2H2O2 (l) => 2H2O (l) + O2 (g)
H 2 CO 3 (ac) => CO2 (g) + H2O (1)
HgO jest czerwonawym ciałem stałym, które w wyniku działania ciepła rozkłada się w metalicznej rtęci, cieczy koloru czarnego i tlenu.
Nadtlenek wodoru lub nadtlenek wodoru ulega rozkładowi, dając ciekłą wodę i tlen.
Natomiast kwas węglowy rozkłada się na dwutlenek węgla i ciekłą wodę.
Bardziej „suchy” rozkład jest spowodowany przez węglany metali:
CaCO3 (s) => CaO (s) + CO 2 (g)
Wulkan klasy

Reakcją rozkładu stosowaną w klasach chemii jest rozkład termiczny dichromianu amonowego (NH 4 ) 2 Cr 2 O 7 . Ta pomarańczowa sól rakotwórcza (dlatego musi być traktowana z najwyższą ostrożnością), pali się, aby uwolnić dużo ciepła i wytworzy zielone ciało stałe, tlenek chromu, Cr 2 O 3 :
(NH 4 ) 2 Cr 2 O 7 (s) => Cr 2 O 3 (s) + 4H 2 O (g) + N 2 (g)
Przemieszczenie

Reakcje wypierania są rodzajem reakcji redoks, w której jeden pierwiastek wypiera inny w związku. Element przemieszczony kończy się zmniejszaniem lub pozyskiwaniem elektronów.
Aby uprościć powyższe, pokazany jest górny obraz. Kręgi reprezentują element. Zauważono, że okrąg w kolorze limonkowym wypiera kolor niebieski, pozostając na zewnątrz; ale nie tylko to, ale niebieskie koło jest zredukowane, a wapno zielone jest utlenione.
Z wodoru
Na przykład następujące równania chemiczne są używane do wyjaśnienia powyższego wyjaśnienia:
2Al (s) + 6HCl (ac) => AlCl3 (ac) + 3H 2 (g)
Zr (s) + 2H 2 O (g) => ZrO2 (s) + 2H 2 (g)
Zn (s) + H2SO4 (ac) => ZnSO4 (ac) + H2 (g)
Jaki jest przemieszczony element dla tych trzech reakcji chemicznych? Wodór, który jest zredukowany do wodoru cząsteczkowego, H2; idzie z liczby utleniania od +1 do 0. Należy zauważyć, że metale glin, cyrkon i cynk mogą wypierać wodory kwasów i wody; podczas gdy miedź, ani srebro, ani złoto, nie może.
Metale i halogeny
Ponadto mamy te dwie dodatkowe reakcje przemieszczenia:
Zn (s) + CuSO 4 (ac) => Cu (s) + ZnSO 4 (ac)
Cl2 (g) + 2NaI (ac) => 2NaCl (ac) + I 2 (s)
W pierwszej reakcji cynk wypiera mniej aktywny metal miedziowy; cynk jest utleniany, podczas gdy miedź jest redukowana.
Z drugiej strony, chlor, bardziej reaktywny pierwiastek niż jod, wypiera ten ostatni w soli sodowej. Tutaj dzieje się odwrotnie: najbardziej reaktywny element jest redukowany przez utlenianie przemieszczonego elementu; dlatego chlor jest redukowany przez utlenianie do jodu.
Tworzenie gazu
W reakcjach można było zauważyć, że kilka z nich generowało gazy, a zatem również wchodzą w ten typ reakcji chemicznej. Podobnie reakcje z poprzedniej części, takie jak przemieszczenie wodoru przez aktywny metal, są uważane za reakcje tworzenia gazu.
Oprócz tych już wspomnianych, na przykład siarczki metali uwalniają siarkowodór (który pachnie jak zgniłe jaja) po dodaniu kwasu solnego:
Na2S (s) + 2 HCl (ac) => 2 NaCl (ac) + H2S (g)
Metateza lub podwójne przemieszczenie

W reakcji metatezy lub podwójnego przemieszczenia zachodzi zmiana par bez przenoszenia elektronów; to znaczy, nie jest uważany za reakcję redoks. Jak pokazano na powyższym obrazku, zielone kółko łamie ciemnoniebieski link, aby połączyć się z jasnoniebieskim okręgiem.
Opady
Gdy oddziaływania jednej z par są wystarczająco silne, aby pokonać efekt solwatacji cieczy, otrzymuje się osad. Następujące równania chemiczne reprezentują reakcje strącania:
AgNO 3 (ac) + NaCl (ac) => AgCl (s) + NaNO 3 (ac)
CaCl2 (aq) + Na2CO3 (ac) => CaCO3 (s) + 2NaCl (ac)
W pierwszej reakcji Cl- wypiera NO3 - tworząc chlorek srebra, AgCl, który jest białym osadem. W drugiej reakcji CO 3 2- wypiera Cl- w celu wytrącenia węglanu wapnia.
Kwasowa baza
Prawdopodobnie najbardziej charakterystyczną reakcją metatezy jest neutralizacja zasady kwasowej. Na koniec pokazano dwie reakcje kwasowo-zasadowe:
HCl (ac) + NaOH (ac) => NaCl (ac) + H2O (1)
2HCl (aq) + Ba (OH) 2 (ac) => BaCl2 (ac) + 2H2O (1)
OH- wypiera Cl- tworząc wodę i sole chlorków.