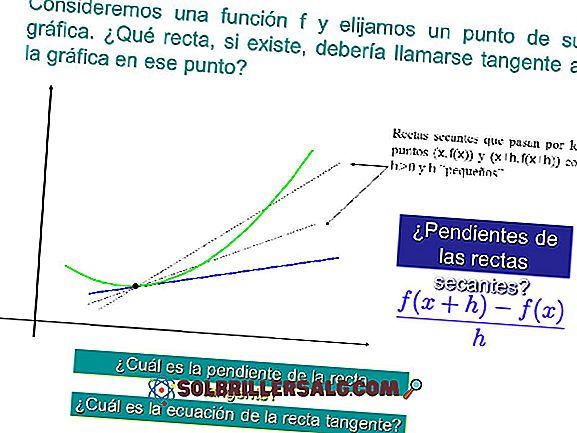
Równoważenie równań chemicznych: metody i przykłady
Równoważenie równań chemicznych oznacza, że wszystkie elementy obecne w tym równaniu mają taką samą liczbę atomów po każdej stronie. Aby to osiągnąć, konieczne jest zastosowanie metod równoważenia, aby przypisać współczynniki stechiometryczne odpowiednie dla każdego gatunku obecnego w reakcji.
Równanie chemiczne to przedstawienie za pomocą symboli tego, co dzieje się w trakcie reakcji chemicznej między dwiema lub więcej substancjami. Reagenty oddziałują ze sobą i, w zależności od warunków reakcji, otrzymany zostanie jeden lub więcej różnych związków jako produkt.

Przy opisywaniu równania chemicznego należy wziąć pod uwagę następujące czynniki: Po pierwsze, substancje reagujące są zapisywane po lewej stronie równania, po czym następuje strzałka jednokierunkowa lub dwie przeciwległe strzałki poziome, w zależności od rodzaju przeprowadzanej reakcji. peleryna
Metody równoważenia równań chemicznych
Biorąc za podstawę, że reagenty i produkty są znane i że ich wzory są poprawnie wyrażone po stronie, która im odpowiada, przechodzimy do równoważenia równań według następujących metod.
Równoważenie równań chemicznych metodą prób i błędów (nazywane również przez kontrolę lub próbę)
Opiera się na stechiometrii reakcji i próbuje próbować z różnymi współczynnikami, aby zrównoważyć równanie, tak długo, jak wybierane są najmniejsze możliwe liczby całkowite, przy których uzyskuje się taką samą liczbę atomów każdego elementu po obu stronach reakcji.
Współczynnikiem reagenta lub produktu jest liczba, która poprzedza jego wzór, i jest to jedyna liczba, którą można zmienić podczas równoważenia równania, ponieważ zmiana indeksów dolnych formuł zmieniłaby tożsamość związku w pytaniu.
Policz i porównaj
Po zidentyfikowaniu każdego elementu reakcji i umieszczeniu go na właściwej stronie, kontynuujemy liczenie i porównywanie liczby atomów każdego elementu obecnego w równaniu i określanie tych, które muszą być zrównoważone.
Następnie kontynuujemy równoważenie każdego elementu (pojedynczo), umieszczając całe współczynniki poprzedzające każdą formułę, która zawiera elementy niezrównoważone. Zwykle pierwiastki metaliczne są najpierw zrównoważone, następnie pierwiastki niemetaliczne, a na końcu atomy tlenu i wodoru.
W ten sposób każdy współczynnik mnoży wszystkie atomy poprzedniego wzoru; tak więc, gdy jeden element jest zrównoważony, inne mogą wytrącać się z równowagi, ale jest to korygowane w miarę zrównoważenia reakcji.
Wreszcie, potwierdza to ostatnia liczba, że całe równanie jest prawidłowo zrównoważone, to znaczy, że przestrzega prawa zachowania materii.
Równoważenie algebraiczne równań chemicznych
Aby użyć tej metody, opracowano procedurę, która traktuje współczynniki równań chemicznych jako niewiadome systemu, który należy rozwiązać.
Po pierwsze, jako element odniesienia przyjmuje się określony element reakcji, a współczynniki są umieszczane jako litery (a, b, c, d ...), które reprezentują niewiadome, zgodnie z istniejącymi atomami tego pierwiastka w każdej cząsteczce (jeśli gatunek nie zawiera tego elementu jest umieszczony „0”).
Po uzyskaniu tego pierwszego równania określa się równania dla innych pierwiastków obecnych w reakcji; będzie tyle równań, ile jest elementów w tej reakcji.
Ostatecznie, niewiadome są określane przez jedną z algebraicznych metod redukcji, wyrównania lub podstawienia i uzyskuje się współczynniki, które prowadzą do poprawnie zrównoważonego równania.
Równoważenie równań redoks (metoda jonowo-elektronowa)
Najpierw ogólna (niezrównoważona) reakcja jest umieszczana w formie jonowej. Następnie równanie to dzieli się na dwie pół-reakcje, utlenianie i redukcję, przy czym każde równoważy się w zależności od liczby atomów, ich rodzaju i ładunków.
Na przykład, w przypadku reakcji zachodzących w środowisku kwaśnym, cząsteczki H2O dodaje się w celu zrównoważenia atomów tlenu, a H + dodaje się w celu zrównoważenia atomów wodoru.
Natomiast w środowisku alkalicznym do obu stron równania dodaje się taką samą liczbę jonów OH- dla każdego jonu H + i gdzie jony H + i OH- spotykają się, tworząc cząsteczki H2O.
Dodaj elektrony
Następnie musisz dodać tyle elektronów, ile potrzeba, aby zrównoważyć ładunki, po zrównoważeniu materii w każdej reakcji połowicznej.
Po przetoczeniu każdej pół-reakcji są one dodawane i kulminowane przez zrównoważenie końcowego równania metodą prób i błędów. W przypadku, gdy istnieje różnica w liczbie elektronów dwóch pół-reakcji, jedna lub obie muszą być pomnożone przez współczynnik równy tej liczbie.
Wreszcie, należy potwierdzić, że równanie zawiera tę samą liczbę atomów i ten sam typ atomów, oprócz tego, że ma te same ładunki po obu stronach globalnego równania.
Przykłady równoważenia równań chemicznych
Pierwszy przykład

To animacja zrównoważonego równania chemicznego. Pięciotlenek fosforu i woda przekształca się w kwas fosforowy.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
Drugi przykład
Masz reakcję spalania etanu (niezrównoważonego).
C2H6 + O2 → C02 + H2O
Wykorzystując metodę prób i błędów do zrównoważenia, zaobserwowano, że żaden z elementów nie ma takiej samej liczby atomów po obu stronach równania. Dlatego zaczynamy od wyważenia węgla, dodając dwa współczynniki stechiometryczne, które towarzyszą mu na stronie produktów.
C2H6 + O2 → 2CO2 + H2O
Węgiel został zrównoważony po obu stronach, więc przechodzimy do równoważenia wodoru, dodając trzy do cząsteczki wody.
C2H6 + O2 → 2CO2 + 3H2O
Wreszcie, ponieważ po prawej stronie równania znajduje się siedem atomów tlenu i jest to ostatni element do zrównoważenia, ułamek liczby 7/2 jest umieszczony przed cząsteczką tlenu (chociaż preferowane są całe współczynniki).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Następnie weryfikuje się, że po każdej stronie równania jest ta sama liczba atomów węgla (2), wodoru (6) i tlenu (7).
Trzeci przykład
Utlenianie żelaza przez jony dichromianowe zachodzi w środowisku kwaśnym (niezrównoważonym iw postaci jonowej).
Fe2 + + Cr 2 O 7 2- → Fe3 + + Cr3 +
Wykorzystując metodę jonowo-elektronową do równoważenia, dzieli się ją na dwie pół-reakcje.
Utlenianie: Fe2 + → Fe3 +
Redukcja: Cr 2 O 7 2- → Cr3 +
Ponieważ atomy żelaza są już zrównoważone (1: 1), elektron jest dodawany do boku produktów, aby zrównoważyć ładunek.
Fe2 + → Fe3 + + e-
Teraz atomy Cr są zrównoważone, dodając dwa do prawej strony równania. Następnie, gdy reakcja zachodzi w środowisku kwaśnym, po stronie produktów dodaje się siedem cząsteczek H2O, aby zrównoważyć atomy tlenu.
Cr2O7 2- → 2Cr 3 + + 7H 2 O
Aby zrównoważyć atomy H, dodaje się czternaście jonów H + po stronie reagentów, a po wyrównaniu materiału ładunki są równoważone przez dodanie sześciu elektronów po tej samej stronie.
Cr2O7 2- + 14H + + 6e- → 2Cr 3 + + 7H 2 O
Na koniec dodaje się obie pół-reakcje, ale ponieważ w reakcji utleniania jest tylko jeden elektron, wszystko to należy pomnożyć przez sześć.
6Fe2 + + Cr2O7 2- + 14H + + 6e- → Fe3 + + 2Cr3 + + 7H 2 O + 6-
Wreszcie elektrony muszą zostać wyeliminowane po obu stronach globalnego równania jonowego, sprawdzając, czy ich ładunek i materia są prawidłowo zrównoważone.