chemia
Prawa stechiometrii opisują skład różnych substancji w oparciu o zależności (w masie) między poszczególnymi gatunkami, które wpływają na reakcję. Cała istniejąca materia jest tworzona przez połączenie, w różnych proporcjach, różnych pierwiastków chemicznych, które tworzą układ okresowy. Związki te podlegają p
Etanamid to substancja chemiczna należąca do grupy organicznych związków azotu. Otrzymuje również nazwę acetamidu, według Międzynarodowej Unii Chemii Czystej i Stosowanej (IUPAC za akronim w języku angielskim). Komercyjnie nazywa się to amidem kwasu octowego. Nazywa się amidem, ponieważ azot jest przyłączony do grupy karbonylowej. Jest pierwotn
Reakcja Maillarda to nazwa reakcji chemicznych między aminokwasami i cukrami redukującymi, które zasłaniają żywność podczas pieczenia, pieczenia, pieczenia i smażenia. Powstają brązowe związki odpowiedzialne za kolor i aromat produktów takich jak skórka chleba, pieczeń wołowa, frytki i pieczone ciasteczka. Reakcja jest u
Chlorek glinu lub trichlorek glinu (AlCl3) jest dwuskładnikową solą utworzoną przez glin i chlor. Czasami pojawia się jako żółty proszek, ponieważ ma zanieczyszczenia z powodu obecności chlorku żelaza (III). Uzyskuje się go poprzez połączenie jego elementów. Aluminium, które ma trzy elektrony na ostatnim poziomie energetycznym (rodzina IIIA), ma tendencję do ich wytwarzania ze względu na jego metaliczny charakter. Chlor z siedmiom
Kwas karboksylowy to termin przypisywany dowolnemu związkowi organicznemu, który zawiera grupę karboksylową. Mogą być również określane jako kwasy organiczne i występują w wielu naturalnych źródłach. Na przykład kwas mrówkowy, kwas karboksylowy, jest destylowany z mrówek i innych owadów, takich jak chrząszcz galerita. Oznacza to, że mr
Kwas alendronowy jest związkiem organicznym należącym do klasyfikacji bisfosfonianów, zwłaszcza tych drugiej generacji; Są to te, które zawierają atomy azotu. Związek ten, podobnie jak reszta bisfosfonianów, ma wysoką strukturalną analogię z nieorganicznym pirofosforanem (PPi). Nieorganiczny pirofosforan jest produktem wielu reakcji syntetycznych w organizmie. Jest on prz
Kwas mrówkowy lub kwas metanowy Jest to najprostszy i najmniejszy związek wszystkich kwasów organicznych. Znany jest również jako kwas metanowy, a jego wzór cząsteczkowy to HCOOH, mający tylko jeden atom wodoru związany z atomem węgla. Jego nazwa pochodzi od słowa formica , które w języku łacińskim oznacza mrówkę. Piętnastowieczn
Kwas winowy jest związkiem organicznym, którego wzór cząsteczkowy to COOH (CHOH) 2 COOH. Ma dwie grupy karboksylowe; to znaczy, może uwolnić dwa protony (H +). Innymi słowy, jest to kwas diprotyczny. Ponadto można go zaklasyfikować jako kwas alderowy (cukier kwaśny) i pochodną kwasu bursztynowego. Jego sól
Chlorek wapnia (CaCl 2) Jest to sól nieorganiczna złożona z wapnia, metalu ziem alkalicznych i chlorowca chlorowego. W tym związku występuje kilka oddziaływań elektrostatycznych, które definiują zewnętrzny wygląd jego kryształów i resztę ich właściwości fizycznych. Ponadto zawsze towarzyszą mu cząsteczki wody, tworzące hydraty o ogólnych wzorach CaCl2 · xH2O, o x = 0, 1, 2, 4 i 6. Gdy x = 0, sól nie m
Reakcja egzotermiczna jest rodzajem reakcji chemicznej, w której zachodzi transfer energii, głównie w postaci uwalniania ciepła lub światła. Nazwa pochodzi od greckiego przedrostka exo , co oznacza „na zewnątrz”; i termin „termiczny”, który odnosi się do ciepła lub temperatury. W tym sensie reakcje egzotermiczne mogą przenosić inne rodzaje energii do środowiska, w którym są wytwarzane, takie jak eksplozje i ich sposób przekazywania energii kinetycznej i dźwiękowej, gdy substancje znajdujące się w fazie gazowej w wysokich temperaturach są rozszerzane. gwałtowny sposób. W ten sam
Roztwory chemiczne są znane jako chemie jednorodne. Są to stabilne mieszaniny dwóch lub więcej substancji, w których jedna substancja (zwana substancją rozpuszczoną) rozpuszcza się w innej (zwanej rozpuszczalnikiem). Roztwory przyjmują fazę rozpuszczalnika w mieszaninie i mogą występować w fazie stałej, ciekłej i gazowej. W naturze wys
Piroliza składa się z procesu rozkładu termicznego, w którym substancje pochodzenia organicznego w znacznej większości są poddawane działaniu wysokich temperatur w środowisku obojętnym (bez obecności tlenu). Gdy materia organiczna jest poddawana obróbce za pomocą pirolizy, otrzymuje się produkty, które są używane w przemyśle. Jednym z element
Termochemia jest odpowiedzialna za badanie modyfikacji kalorycznych przeprowadzanych w reakcjach między dwoma lub więcej gatunkami. Uważany jest za istotną część termodynamiki, która bada przemianę ciepła i inne rodzaje energii, aby zrozumieć kierunek, w którym rozwijają się procesy i jak zmienia się ich energia. Istotne jest
Azotan potasu jest trójskładnikową solą złożoną z potasu, metalu alkalicznego i azotanu oksoanionu. Jego wzór chemiczny to KNO 3 , co oznacza, że dla każdego jonu K + występuje jon NO 3 - oddziałujący z nim. Dlatego jest to sól jonowa i stanowi jeden z azotanów metali alkalicznych (LiNO 3 , NaNO 3 , RbNO 3 ...). KNO 3 jest si
Difenyloamina jest związkiem organicznym o wzorze chemicznym (C 6 H 5 ) 2 NH. Jego nazwa wskazuje, że jest to amina, jak również jej wzór (-NH 2 ). Z drugiej strony, termin „difenyl” odnosi się do obecności dwóch pierścieni aromatycznych związanych z azotem. W związku z tym difenyloamina jest aminą aromatyczną. W świecie związ
Chlorek strontu jest związkiem nieorganicznym utworzonym przez stront, metal ziem alkalicznych (Mr. Becamgbara) i chlor chlorowy. Ponieważ oba elementy mają bardzo różne elektroujemności, związek jest jonowym ciałem stałym, którego wzór chemiczny to SrCl 2 . Ponieważ jest to jonowe ciało stałe, składa się z jonów. W przypadku SrC
Fenoloftaleina jest organicznym barwnikiem, który z kolei jest słabym kwasem diprotycznym, stosowanym w wielu oznaczeniach objętościowych jako wskaźnik kwasowo-zasadowy. Oznacza to, że jeśli jest to kwas diprotyczny, w roztworze może utracić dwa jony H + i, aby być wskaźnikiem, musi mieć właściwość bycia kolorowym w zakresie pH, który jest oceniany. W podłożu podst
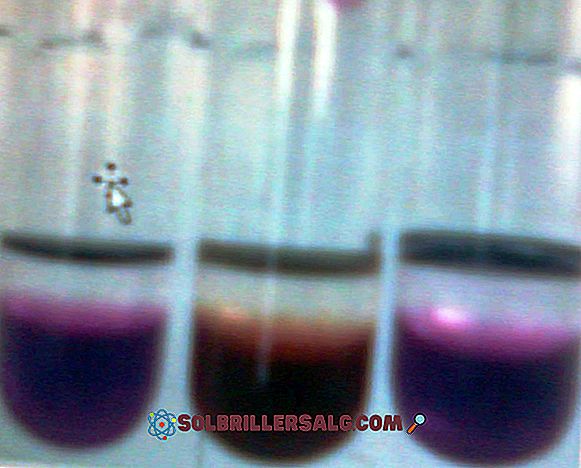
Nadmanganian potasu (KMnO 4) jest związkiem nieorganicznym utworzonym przez mangan - grupa metalu przejściowego 7 (VIIB) -, tlen i potas. To ciemnopurpurowe ciało szkliste. Ich roztwory wodne są również ciemnofioletowe; Roztwory te stają się mniej fioletowe, ponieważ są rozcieńczane w większych ilościach wody. KMnO 4 nast
Tlenek strontu , którego wzór chemiczny to SrO (nie należy mylić z nadtlenkiem strontu, którym jest SrO2), jest produktem reakcji utleniania między tym metalem a tlenem obecnym w powietrzu w temperaturze pokojowej: 2Sr (s) + O2 (g) → 2SrO (s). Kawałek strontu spala się w kontakcie z powietrzem w wyniku jego wysokiej reaktywności, a ponieważ ma on konfigurację elektronową typu ns2, łatwo otrzymuje dwa elektrony walencyjne, zwłaszcza cząsteczkę dwuatomową tlenu. Jeśli powierzchni
Różnicowy lub różnicujący elektron to ostatni elektron umieszczony w sekwencji elektronicznej konfiguracji atomu. Dlaczego ma na imię? Aby odpowiedzieć na to pytanie, niezbędna jest podstawowa struktura atomu: jego jądro, próżnia i elektrony. Jądro jest zwartym, zwartym skupiskiem pozytywnych cząstek zwanych protonami i neutralnych cząstek zwanych neutronami. Protony defi
Hydroksyapatyt jest minerałem fosforanu wapnia, którego wzór chemiczny to Ca 10 (PO 4 ) 6 (OH) 2 . Wraz z innymi minerałami i materią organiczną pozostaje rozdrobniony i zagęszczony, tworzy surowiec znany jako skała fosforowa. Termin „hydroksyl” odnosi się do anionu OH-. Gdyby zamiast tego anionu znajdował się fluorek, minerał nazywałby się fluoroapatytem (Ca 10 (PO 4 ) 6 (F) 2 , a więc z innymi anionami (Cl-, Br-, CO 3 2-, itp.)., hydroksyapatyt
Fosforan magnezu to termin odnoszący się do rodziny związków nieorganicznych utworzonych przez magnez, metal ziem alkalicznych i fosforan oksoanionu. Najprostszy fosforan magnezu ma wzór chemiczny Mg 3 (PO 4 ) 2 . Wzór wskazuje, że na każde dwa aniony PO 4 3 występują trzy kationy Mg2 + oddziałujące z nimi. Ponadto zw
Szkło Pyrex to specjalne szkło borokrzemianowe, którego marka (Pyrex) pojawiła się w Nowym Jorku w 1915 roku, wyprodukowana przez Corning Glass. Pojawił się jako materiał na nowoczesne opakowania do żywności, również używany do przechowywania i pieczenia żywności w tym samym rodzaju pojemnika. Pochodzenie s
Enancjomery to te pary związków organicznych (i nieorganicznych), które składają się z dwóch lustrzanych obrazów, które nie mogą zachodzić na siebie. Kiedy dzieje się coś przeciwnego - na przykład w przypadku piłki, kijka golfowego lub widelca - mówi się, że są to obiekty achiralne. Termin chiralność
Metale nieżelazne to te, które nie mają lub mają niewielkie ilości żelaza. Te, w różnych proporcjach masowych, są wykorzystywane do tworzenia stopów, które wykazują lepsze właściwości fizyczne niż pojedyncze metale. Tak więc jego struktury krystaliczne i oddziaływania metali są podstawą zastosowań stopów nieżelaznych. Jednak te czyste meta
Strącanie lub wytrącanie chemiczne to proces, który polega na tworzeniu nierozpuszczalnego ciała stałego z mieszaniny dwóch jednorodnych roztworów. W przeciwieństwie do opadów deszczu i śniegu, w tego typu opadzie „pada deszcz” z powierzchni cieczy. W dwóch jednorodnych roztworach jony rozpuszczają się w wodzie. Gdy oddziałują
Metaliczny charakter elementów układu okresowego odnosi się do wszystkich tych zmiennych, chemicznych i fizycznych, które definiują metale lub odróżniają je od innych substancji natury. Są one generalnie jasne, gęste, twarde, o wysokiej przewodności cieplnej i elektrycznej, formowalne i ciągliwe. Jednak nie
Sole diazoniowe są związkami organicznymi, w których występują interakcje jonowe między grupą azową (-N2 +) i anionem X- (Cl-, F-, CH3COO-, itp.). Jego ogólny wzór chemiczny to RN 2 + X- iw tym łańcuch boczny R może być grupą alifatyczną lub grupą arylową; to znaczy pierścień aromatyczny. Struktura jonu are
Metale żelazne to takie, które zawierają żelazo (Fe), a także niewielkie ilości innych metali, które dodaje się, aby nadać im pewne korzystne właściwości. Chociaż żelazo może występować w różnych stanach utleniania, najczęściej występują +2 (żelazo) i +3 (żelazo). Jednakże określenie „żelazny” odnosi się do obecności żelaza niezależnie od jego stanu utlenienia w materiale. Żelazo jest czwartym najbardziej r
Teoria pasma to taka, która definiuje elektronową strukturę bryły jako całości. Może być stosowany do każdego rodzaju bryły, ale znajduje się w metalach, w których odbijają się największe sukcesy. Zgodnie z tą teorią, wiązanie metaliczne wynika z przyciągania elektrostatycznego między jonami naładowanymi dodatnio i elektronami ruchomymi w krysztale. Dlatego metaliczny